Thomas Dalton
0
3309
241
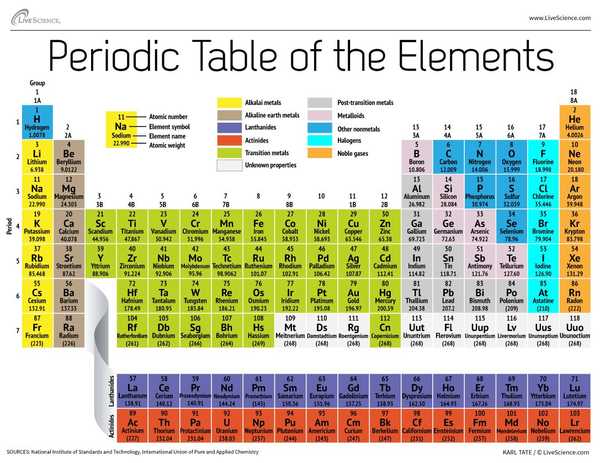
No final do século 19, o químico russo Dmitri Mendeleev publicou sua primeira tentativa de agrupar elementos químicos de acordo com seus pesos atômicos. Havia apenas cerca de 60 elementos conhecidos na época, mas Mendeleev percebeu que quando os elementos eram organizados por peso, certos tipos de elementos ocorriam em intervalos regulares, ou períodos.
Hoje, 150 anos depois, os químicos reconhecem oficialmente 118 elementos (após a adição de quatro novatos em 2016) e ainda usam a tabela periódica de elementos de Mendeleev para organizá-los. A tabela começa com o átomo mais simples, o hidrogênio, e então organiza o resto dos elementos pelo número atômico, que é o número de prótons que cada um contém. Com algumas exceções, a ordem dos elementos corresponde ao aumento da massa de cada átomo.
A tabela possui sete linhas e 18 colunas. Cada linha representa um período; o número do período de um elemento indica quantos de seus níveis de energia abrigam elétrons. O sódio, por exemplo, fica no terceiro período, o que significa que um átomo de sódio normalmente tem elétrons nos três primeiros níveis de energia. Descendo na tabela, os períodos são mais longos porque são necessários mais elétrons para preencher os níveis externos maiores e mais complexos.
As colunas da tabela representam grupos ou famílias de elementos. Os elementos em um grupo costumam ter aparência e comportamento semelhantes, porque têm o mesmo número de elétrons em sua camada mais externa - o rosto que mostram ao mundo. Os elementos do grupo 18, no lado direito da tabela, por exemplo, têm camadas externas completamente cheias e raramente participam de reações químicas.
Os elementos são normalmente classificados como metal ou não metal, mas a linha divisória entre os dois é difusa. Os elementos de metal são geralmente bons condutores de eletricidade e calor. Os subgrupos dentro dos metais são baseados nas características semelhantes e propriedades químicas dessas coleções. Nossa descrição da tabela periódica usa agrupamentos comumente aceitos de elementos, de acordo com o Laboratório Nacional de Los Alamos.
Metais alcalinos: Os metais alcalinos constituem a maior parte do Grupo 1, a primeira coluna da tabela. Brilhante e macio o suficiente para cortar com uma faca, esses metais começam com lítio (Li) e terminam com frâncio (Fr). Eles também são extremamente reativos e explodem em chamas ou mesmo explodem em contato com a água, por isso os químicos os armazenam em óleos ou gases inertes. O hidrogênio, com seu único elétron, também vive no Grupo 1, mas o gás é considerado um não metal.
Metais alcalinos terrestres: Os metais alcalino-terrosos constituem o Grupo 2 da tabela periódica, do berílio (Be) ao rádio (Ra). Cada um desses elementos tem dois elétrons em seu nível de energia mais externo, o que torna os alcalino-terrosos reativos o suficiente para que raramente sejam encontrados sozinhos na natureza. Mas eles não são tão reativos quanto os metais alcalinos. Suas reações químicas normalmente ocorrem mais lentamente e produzem menos calor em comparação com os metais alcalinos.
Lantanídeos: O terceiro grupo é muito longo para caber na terceira coluna, por isso é quebrado e virado de lado para se tornar a linha superior da ilha que flutua na parte inferior da tabela. São os lantanídeos, elementos 57 a 71 - lantânio (La) a lutécio (Lu). Os elementos deste grupo têm uma cor branca prateada e embaçam ao contato com o ar.
Actinídeos: Os actinídeos alinham a linha inferior da ilha e compreendem os elementos 89, actínio (Ac), a 103, lawrencium (Lr). Destes elementos, apenas tório (Th) e urânio (U) ocorrem naturalmente na Terra em quantidades substanciais. Todos são radioativos. Os actinídeos e os lantanídeos juntos formam um grupo denominado metais de transição interna.
Metais de transição: Voltando ao corpo principal da tabela, o restante dos Grupos 3 a 12 representam o restante dos metais de transição. Rígidos, mas maleáveis, brilhantes e com boa condutividade, esses elementos são o que você normalmente pensa quando ouve a palavra metal. Muitos dos maiores sucessos do mundo do metal - incluindo ouro, prata, ferro e platina - moram aqui.
Metais pós-transição: Antes do salto para o mundo do não metal, as características compartilhadas não estão nitidamente divididas ao longo de linhas de grupo verticais. Os metais pós-transição são alumínio (Al), gálio (Ga), índio (In), tálio (Tl), estanho (Sn), chumbo (Pb) e bismuto (Bi), e eles abrangem o Grupo 13 ao Grupo 17. Esses elementos têm algumas das características clássicas dos metais de transição, mas tendem a ser mais macios e ter um comportamento mais fraco do que outros metais de transição. Muitas tabelas periódicas apresentarão uma linha "escada" em negrito abaixo da diagonal conectando o boro com o astato. Os metais pós-transição aglomeram-se na parte inferior esquerda desta linha.
Metalóides: Os metalóides são boro (B), silício (Si), germânio (Ge), arsênio (As), antimônio (Sb), telúrio (Te) e polônio (Po). Eles formam a escada que representa a transição gradual de metais para não metais. Esses elementos às vezes se comportam como semicondutores (B, Si, Ge) em vez de condutores. Os metalóides também são chamados de "semimetais" ou "metais pobres".
Não metais: Todo o resto no canto superior direito da escada - mais o hidrogênio (H), retido no Grupo 1 - é um não metal. Estes incluem carbono (C), nitrogênio (N), fósforo (P), oxigênio (O), enxofre (S) e selênio (Se).
Halogênios: Os quatro principais elementos do Grupo 17, de flúor (F) a astato (At), representam um dos dois subconjuntos de não metais. Os halogênios são bastante reativos quimicamente e tendem a se emparelhar com metais alcalinos para produzir vários tipos de sal. O sal de cozinha em sua cozinha, por exemplo, é um casamento entre o sódio, metal alcalino e o cloro halógeno.
Gases nobres: Incolores, inodoros e quase completamente não reativos, os gases inertes ou nobres completam a tabela no Grupo 18. Muitos químicos esperam que oganesson, um dos quatro elementos recém-nomeados, compartilhe essas características; entretanto, como esse elemento tem meia-vida medida em milissegundos, ninguém foi capaz de testá-lo diretamente. Oganesson completa o sétimo período da tabela periódica, então se alguém conseguir sintetizar o elemento 119 (e a corrida para fazer isso já está em andamento), ele fará um loop para iniciar a linha oito na coluna de metal alcalino.
Devido à natureza cíclica criada pela periodicidade que dá nome à tabela, alguns químicos preferem visualizar a tabela de Mendeleev como um círculo.
Adicional Recursos:
- Assista a este breve vídeo sobre a tabela periódica e grupos de elementos do Crash Course.
- Percorra esta tabela periódica interativa de elementos.
- Confira este recurso educacional online gratuito para compreender grupos elementares de CK-12.















